新版《药品生产监督管理办法》草案热点解读
新版《药品生产监督管理办法》草案热点解读

2019年9月30日,70周年国庆放假前最后一个工作日,国家药品监督管理局官网发布《药品生产监督管理办法》(修订草案征求意见稿),公示期为一个月,这是历时15年之后的一次全面大修,新版《药品生产监督管理办法》草案共七章七十四条,本次《药品生产监督管理办法》的修订,比较系统地回答了在新体制机制下,未来生产监管什么、怎么监管的问题。
热点导读:
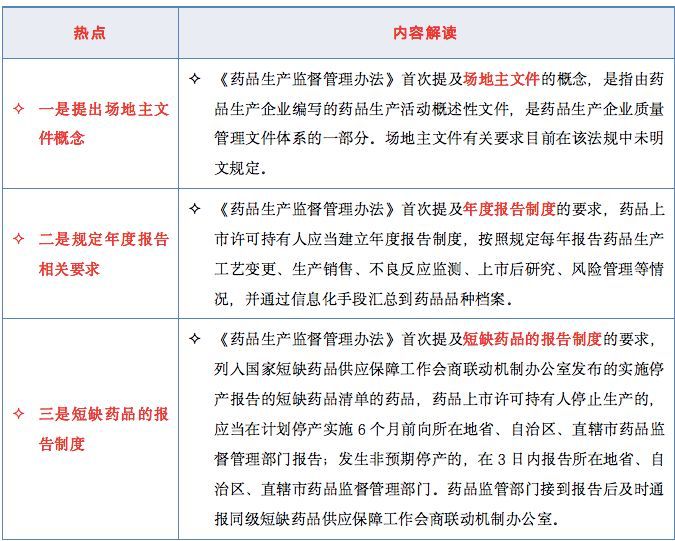
1、首次提及场地主文件的概念;
2、首次提及年度报告制度的要求;
3、首次提及短缺药品的报告制度的要求;
4、明确取消药品GMP认证;
5、坚持许可标准不降低;
6、整合充实许可证管理规定;
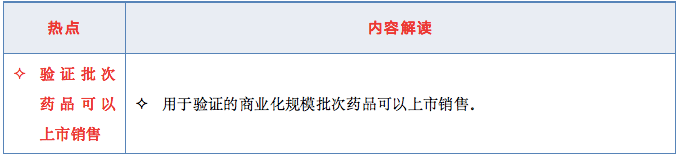
7、验证批次药品可以上市销售;
8、明确国家局主管全国药品生产监督管理工作;
9、明确核查中心监管事权;
10、明确所在地省局监管事权;
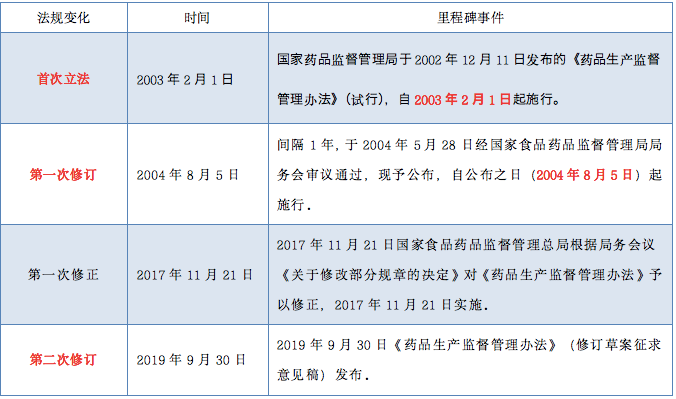
一、《药品生产监督管理办法》政策演变
药品,关系14亿中国人民群众生命健康,关系公共卫生安全和国家安全,2019年4月,国家药监局正式启动《药品生产监督管理办法》的修订工作,组建起草专班,加快工作推进。2019年9月30日《药品生产监督管理办法》(修订草案征求意见稿)发布,备受大家关注,从2003年首次立法到2004年第一次修订间隔了1年,而时隔15年之后,我们将迎来《药品生产监督管理办法》的重大变革(第二次修订)。
二、《药品生产监督管理办法》(修订草案征求意见稿)热点解析
2.1 热点1——“新”意满满
2.2 热点2——实现了《GMP证书》和《生产许可证》“两证合一”

2.3 热点3——验证批次药品可以上市销售
2.4 热点4——适应监管改革、落实简政放权情况

来源:蒲公英









 甘公网安备 62112602000025号
甘公网安备 62112602000025号